Роль кальция в коагуляционном гемостазе
Коагуляционный (вторичный, макроциркуляторный) гемостаз
Гемокоагуляция или свертывание крови (от греч. haima – кровь и лат. coagulo, сoagulare – вызывать свертывание) – это цепной ферментативный процесс, в котором последовательно происходит активация плазменных факторов свертывания на фосфолипидных матрицах и образование их комплексов.
Этот механизм является непосредственным продолжением микроциркуляторного гемостаза, но осуществляется по принципиально отличным от него механизмам. Имеет решающее значение при травме крупных сосудов (артерий и вен с диаметром более 200 мкм) и протекает через ряд последовательных фаз, целью которых является образование фибринового тромба, способного остановить кровотечение из сосудов с высоким давлением.
Свертывание крови можно представить в виде последовательно протекающих фаз (рис.5):
1) образование активной протрамбиназы;
2) образование тромбина из неактивного протромбина под влиянием протромбиназы;
3) образование нерастворимого фибрина.
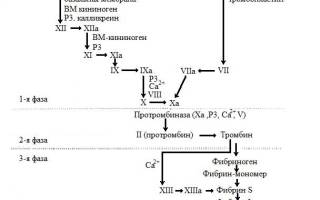
Рис. 5. Схема свертывания крови
Первая фаза является самой сложной и продолжительной. Во время этой фазы происходит образование активного ферментного комплекса – протрамбиназы, являющейся активатором протромбина. Протромбиназа представляет собой комплекс активных факторов свертывания P3+FXa+FVa+Са 2+ . Формирование этого комплекса идет двумя путями: внешним (или тканевым) и внутренним (или кровяным). Критерием для выделения этих двух путей служит источник клеточных мембран. Если источником являются мембраны клеток, внешние по отношению к крови – это внешний путь. Он происходит с участием тканевого (полного) тромбопластина. Если же источником мембран являются форменные элементы самой крови – это внутренний путь. В нем участвует частичный, или парциальный, тромбопластин, преимущественно тромбоцитов и в меньшей степени эритроцитов. Как полный, так и парциальный тромбопластин являются матрицами, на которых развертываются ферментивные реакции.
Образование протромбиназы по внешнему пути начинается с высвобождения очень активного тканевого тромбопластина из мембран клеток поврежденных стенок сосуда и окружающих тканей. Он взаимодействует с Са 2+ и FVII, в результате чего образуется FVIIа. Активированный FVII вместе с фосфолипидами тканей и ионами кальция образует комплекс, который активирует FX. Активированный FX с помощью ионизированного кальция взаимодействует с фиксированным на фосфолипидах FVа. Таким образом, на тканевом тромбопластине формируется комплекс активных факторов FIII (FXa+FVa+Ca 2+ ), или тканевая протромбиназа, обладающая высокой католической активностью по отношению к протромбину. Этот процесс длится всего 10-15 с.
Образование протромбиназы по внутреннему пути начинается с активации фактора контакта (FXII), или фактора Хагемана, при его взаимодействии с обнажившейся базальной мембраной поврежденных сосудов, волокнами коллагена. В активации и действии FXII участвуют также высокомолекулярный кининоген (FXVa) и калликреин (FXIVa). Затем FXIIa активирует FXI, а FXIa активирует FIX. Эта реакция протекает на поверхности фосфолипидов тромбоцитов при обязательном участии FVIIIa. FXa взаимодействует с активированным на матрице мембраны FVa при участии ионизированного кальция. Таким образом, на фосфолипидах тромбоцитов формируется кровяная протромбиназа – Р3(FXa+FVa+Ca 2+ ). Этот процесс длится 5-10 мин.
Вторая фаза. Образовавшаяся протромбиназа запускает вторую фазу свертывания крови – образование тромбина из протромбина в присутствии ионов кальция. Этот процесс длится 2-5 с.
Третья фаза. В третьей фазе происходит образование нерастворимого фибрина из фибриногена. В начале под влиянием тромбина происходит образование растворимого фибрин-мономера. Тромбин также активирует фибринстабилизирующий фактор. Затем с участием ионов кальция образуется растворимый фибрин-полимер. Под влиянием активного фибринстабилизирующего фактора происходит образование нерастворимого фибрина-полимера. В фибриновых нитях оседают форменные элементы крови, в частности эритроциты, и формируется кровяной сгусток или тромб (красный тромб), который закупоривает рану.
Тромб – это сгусток, состоящий из нитей фибрина и осевших в ней форменных элементов (эритроцитов и лейкоцитов), прикрепленный к стенке сосуда. В дальнейшем тромб подвергается двум процессам: ретракции и фибринолизу.
После образования сгустка тромб начинает уплотняться, и из него выдавливается сыворотка. Этот процесс называется ретракцией сгустка. Ретракция происходит при участии сократительного белка тромбоцитов тромбостенина и ионов кальция. Через 2-3 ч сгусток сжимается до 25-50 % своего первоначального объема и из него выделяется, как бы выжимается, вся жидкая часть крови, именуемая сывороткой. (сыворотка – это плазма крови, лишенная фибриногена). За счет ретракции тромб становится плотным, жестко фиксированным в месте повреждения.
Одновременно с ретракцией сгустка начинается постепенное ферментативное растворение образовавшегося фибрина – фибринолиз. Результатом фибринолиза является восстановление просвета закупоренного тромбом сосуд.
Факторы, ускоряющие процесс свертывания крови:
– ионы кальция (участвуют во всех фазах свертывания);
– разрушение форменных элементов крови и клеток тканей ( при этом увеличивается выход факторов , участвующих в свертывании крови);
– витамин К (принимает участие в синтезе протромбина;
– тепло (свертывание является ферментативным процессом, ускоряющимся при повышении температуры);
Гемостаз в крови: механизмы и нормы
Гемостаз — это биологическая система, сохраняющая жидкое состояние крови, предупреждающая или тормозящая кровопотери путем поддержания целостности сосудистой стенки и образования тромбов в местах повреждения сосудов.
К физиологическому звену относят нейрогуморальные механизмы регуляции взаимоотношений I и II звеньев гемостаза.
С позиции патофизиологии и клиники предпочтительнее различать первичный и вторичный гемостаз.
Первичный (сосудисто-тромбоцитарный) гемостаз
Первичный гемостаз обеспечивается сосудистой стенкой, тромбоцитами и отчасти эритроцитами. Ему принадлежит ведущая роль в начальной остановке кровотечения в зоне микроциркуляции. Конечный результат — образование белого тромба.
Наряду с эндотелием в первичном гемостазе участвуют тромбоциты.
Механизм образования первичного тромба:
При повреждении стенок кровеносного сосуда тромбоциты вступают в контакт с эндотелием, в частности, с главным стимулятором адгезии — коллагеном. Тромбоциты набухают, образуют отростки и приклеиваются на участке повреждения. Параллельно адгезии протекает процесс агрегации тромбоцитов — набухание и склеивание между собой с образованием отростков и наложением агрегатов на дефект сосуда, вследствие чего гемостатическая пробка, или тромб, быстро растет. Первичный стимул к агрегации дают коллаген, катехоламины и серотонин, выделяющиеся из сосудистой стенки при повреждении.
Из тромбоцитов, подвергшихся адгезии и агрегации, активно секретируются гранулы, содержащие вещества, усиливающие процесс агрегации и формирующие вторую волну агрегации. В цитоплазме тромбоцита существует 4 вида гранул, которые содержат катехоламины, кальций, тромбоксан, тромбостенин, а также 12 эндогенных факторов.
Кроме того, для осуществления агрегационной функции очень важны мембранные гликопротеиды тромбоцитов, взаимодействующие с агрегирующими агентами.
Вторичный (коагуляционный) гемостаз
Первичная тромбоцитарная пробка не может надежно остановить кровотечение, особенно из крупных сосудов и сосудов с достаточно высоким давлением, поэтому тромбоцитарная пробка через определенный промежуток времени стабилизируется фибрином. Для этого включаются механизмы вторичного гемостаза — непосредственного свертывания крови.
Свертывание крови — сложный многоэтапный ферментный процесс, в котором участвуют ряд белков-ферментов, а также неферментные белки-акцелераторы, обеспечивающие взаимодействие факторов свертывания на фосфолипидных матрицах.
Перечень факторов, участвующих, в свертывании крови, и характеристика некоторых их свойств представлены в следующей таблице.
| Номер фактора | Название фактора | Содержание в крови, г/л | Период полураспада в плазме | Минимальный уровень, необходимый для гемостаза |
|---|---|---|---|---|
| I | Фибриноген | 2-4 | 3-5 дней | 0,8 г/л |
| II | Протромбин | 0,1 | 3-4 дня | 40% |
| III | Тканевой тромбопластин | — | ? | — |
| IV | Ионизированный кальций | 1,1-1,4 ммоль/л | — | — |
| V | Проакцелерин | 0,01 | 18-24 ч | 10-15% |
| VII | Проконвертин | 0,005 | 4-6 ч | 5-10% |
| VIII | Антигемофильный глобулин А | 0,01-0,02 | 12-18 ч | 30-35% |
| IX | Антигемофильный глобулин В (фактор Кристмаса) | 0,003 | 20-30 ч | 20-30% |
| X | Фактор Стюарта-Прауэра | 0,01 | 48-56 ч | 10-20% |
| XI | Фактор Розенталя | 0,005 | 60 ч | ? |
| XII | Фактор Хагемана | 0,03 | 50-70 ч | менее 1% |
| XIII | Фибринстабилизирующий фактор | 0,01-0,02 | около 3 дней | 2-5% |
| Прекалликреин (фактор Флетчера) | 0,05 | ? | менее 1% | |
| Высокомолекулярный кининоген (фактор Фитцджеральда) | 0,06 | ? | менее 1% |
Известно, что имеются два основных механизма запуска процесса свертывания — внешний и внутренний. Во внешнем механизме свертывание стимулируется поступлением в плазму тканевого тромбопластина (фактора III). Пусковым фактором внутреннего механизма свертывания крови является фактор ХII, активация которого происходит либо вследствие контакта крови с чужеродной поверхностью (стеклом, металлом, каолином и так далее), либо при контакте крови с субэндотелием (коллагеном) и другими компонентами соединительной ткани, что наблюдается при повреждении стенок кровеносных сосудов. Помимо этого активация фактора XII может осуществляться путем его ферментного расщепления (калликреином, плазмином и другими).
Следовательно, существуют два вида активации фактора XII:
Есть определенные качественные различия между действием фактора ХIIа (больше влияет на свертывание) и фактора Xllf (оказывает активирующее действие больше на калликреин-кининовой систему и фибринолиз), В целом же фактор XII является универсальным активатором всех плазменных протеолитических систем — свертывающей, калликреин-кининовой, фибринолитической и системы комплемента.
Как при внешнем, так и при внутреннем механизме свертывания взаимодействие и активация факторов осуществляются на фосфолипидных мембранах, играющих роль матриц, на которых факторы свертывания фиксируются, меняют свою структуру и интенсивно реагируют друг на друга. Роль таких матриц выполняют мембраны оболочек и гранул тромбоцитов (тромбоцитарный фактор 3) и сходные с ними компоненты из оболочек других клеток (эритроцитов и других). Поэтому тромбоцитопения (при недостатке фосфолипидных мембран) может привести к удлинению времени свертывания, а гемолиз (освобождение большого количества эритроцитарных мембран) — к ускорению свертывания крови.
В результате активации внутреннего и внешнего механизмов свертывания крови образуется активный протромбиназный комплекс, который в 300000 раз активнее, чем один фактор Ха. Такой комплекс, действуя на протромбин, превращает его в активный альфа-тромбин. Протеолитический фермент тромбин отщепляет от молекулы фибриногена 4 пептида, в результате чего образуется фибрин-мономер. Фибрин-мономер сначала образует димеры, а затем превращается в фибрин-полимер, формируя волокна фибрина. Данный фибрин растворим в мочевине, в связи с чем обозначается как фибрин S (soluble). Под влиянием фактора ХIII в фибрине образуются дополнительные дисульфидные связи, что делает его нерастворимым в мочевине — фибрин I (insoluble).
Важные особенности системы свертывания крови:
1. Факторы II, VII, IX и X, а также два антикоагулянта (протеины С и S) являются К-витаминзависимыми, то есть дефицит витамина К приводит к нарушению карбоксилирования глутаминовой кислоты этих факторов в гепатоците, что лишает факторы свертывания способности превращаться в активные энзимы.
2. Ионизированный кальций является необходимым компонентом для свертывания крови, поскольку участвует в молекулярной конформации факторов свертывания в активную форму, фиксации факторов на фосфолипидных матрицах.
3. Из плазменных факторов свертывания лишь фактор VII участвует только во внешнем механизме, факторы ХII, XI, IX, VIII и прекалликреин участвуют только во внутреннем механизме активации. На факторах I, II, V и X замыкаются оба механизма свертывания.
4. Учитывая, что фактор VIII имеет большое значение для клиники, следует более детально рассмотреть его структуру и функции. Этот фактор состоит из 3 субъединиц: VIII-К, VIII-Ag, VIII-ФВ. Субъединица VIII-К — носитель коагуляционной активности — взаимодействует с фактором X и образует протромбиназный комплекс. Субъединица VIII-Ag — носитель антигенной активности данного фактора. Субъединица VIII-ФВ содержит фактор Виллебранда (ФВ), который синтезируется и депонируется в эндотелии сосудов, вследствие чего используется в качестве маркера повреждения эндотелия, его уровень значительно увеличивается при сосудистых заболеваниях.
В крови ФВ содержится в альфа-гранулах тромбоцитов и в связанном состоянии с VIII фактором. Дефицит фактора Виллебранда приводит как к нарушению агрегационных свойств тромбоцитов, так и снижению коагуляционной активности.