Инфаркт миокарда без обструкции коронарных артерий
Риск развития инфаркта миокарда при необструктивном поражении коронарных артерий: результаты ретроспективного обсервационного исследования
Источник: Maddox T.M., Stanislawski M.A., Grunwald G.K., et al. Nonobstructive coronary artery disease and risk of myocardial infarction. JAMA 2014;312:1754—1763.
Предпосылки к проведению исследования
Предполагается, что при необструктивных формах коронарной болезни сердца (КБС) атеросклеротические бляшки (АБ) в коронарных артериях (КА) не приводят к нарушению коронарного кровотока или развитию симптомов стенокардии. Несмотря на то что такие изменения широко распространены и отмечаются у 10—25% больных, которым выполняют коронарографию (КГ), в медицинской литературе эти изменения обозначаются термином «клинически незначимая КБС». Однако такое отношение к необструктивной КБС может быть неправильным, поскольку результаты ранее выполненных исследований свидетельствовали о том, что большинство случаев разрыва АБ с развитием инфаркта миокарда (ИМ) отмечается в АБ, которые не обусловливают обструкцию КА.
Несмотря на высокую частоту выявления необструктивных поражений КА при выполнении КГ, до последнего времени было мало данных о влиянии таких поражений на прогноз. В ходе выполнения лишь небольшого числа исследований основное внимание уделяли больным с ИМ, у которых имелись необструктивные поражения КА, но имеется недостаточно данных о больных с таким поражением и стабильным течением КБС.
Следует отметить, что почти все регистры, в которых учитывались результаты КГ, включали только данные о больных с КБС и обструктивными поражениями КА. В ходе выполнения небольшого числа регистров, включавших данные о больных с необструктивной КБС, проспективно не оценивали частоту развития неблагоприятных клинических исходов. В то же время очевидно, что для уточнения риска развития неблагоприятных исходов и возможных терапевтических вмешательств требуется больше информации о больных с необструктивной КБС, в том числе, данные о частоте развития таких исходов, которые были бы получены проспективно.
Проверить гипотезу о том, что прогрессирование КБС от необструктивных до обструктивных форм сопровождается постепенным увеличением частоты развития ИМ и общей смертности.
Ретроспективное когортное исследование.
Материал и методы исследования
В анализ были включены данные обо всех больных, включенных в программу CART (Veterans Affairs Clinical Assessment, Reporting, and Tracking), у которых в период между октябрем 2007 г. и сентябрем 2012 г. в одной из 79 рентгеноперационных выполнялась плановая КГ в связи с предполагаемой КБС (боли в грудной клетке, стабильная стенокардия, ишемическая болезнь сердца или положительные результаты функциональных проб). В соответствии со стандартными определениями, необструктивная КБС диагностировалась при стенозе КА более чем на 20%, но менее чем на 50% в случае поражения ствола левой КА или более чем на 20%, но менее чем на 70% в случае поражения любой другой эпикардиальной артерии. Обструктивную КБС диагностировали при любом поражении КА на 50% или более в случае поражения ствола левой КА и/или на 70% или более в случае поражения любой другой КА. Отсутствие КБС определяли как отсутствие стеноза хотя бы на 20% или наличие лишь неровности контуров просвета КА.
В качестве основного показателя использовали частоту госпитализаций по поводу несмертельного ИМ после выполнения первой КГ. Кроме того, оценивали такие дополнительные показатели, как общая смертность в течение 1 года и комбинированный показатель частоты развития ИМ и общей смертности в течение 1 года.
Частоту развития ИМ, а также общую смертность и комбинированный показатель в течение всего периода наблюдения оценивали и сопоставляли с выраженностью КБС с помощью лог-рангового критерия и кривых Каплана—Мейера. Нестандартизованную частоту развития неблагоприятных исходов рассчитывали с помощью метода Каплана—Мейера для включения данных обо всех больных с использованием цензурированных данных. Регрессионную модель Кокса применяли для стандартизации с учетом ковариат, которые выбирали на основании результатов ранее выполненных исследований и клинической обоснованности. Все данные учитывали как цензурированные через 1 год после выполнения КГ. Данные о больных, у которых не было явных признаков КБС, использовали в качестве контроля.
Из 37 674 обследованных больных необструктивная КБС и обструктивная КБС диагностировалась у 22,3 и 55,4% соответственно. В течение 1 года умерли или были госпитализированы по поводу ИМ 845 и 385 больных соответственно. В отсутствие явных признаков КБС частота развития ИМ в течение года составляла 0,11% (при 95% ДИ от 0,10 до 0,2%) и увеличивалась прогрессивно при необструктивной КБС с поражением 1 КА до 0,24% (при 95% от 0,10 до 0,4%), с поражением 2 КА до 0,56% (при 95% ДИ от 0,3 до 1,0%) и с поражением 3 КА до 0,59% (при 95% ДИ от 0,3 до1,3%), а также при обструктивной КБС с поражением 1 КА до 1,18% (при 95% ДИ от 1,0 до 1,4%), 2 КА до 2,18% (при 95% ДИ от 1,8 до 2,6%) и 3 КА до 2,47% (при 5% ДИ от 2,1 до 2,9%). Результаты анализа, выполненного с учетом дополнительных факторов, также свидетельствовали об увеличении частоты развития ИМ с увеличением распространенности КБС. По сравнению с больными, у которых отсутствовали явные признаки КБС, в группе больных с необструктивной КБС и поражением 1 КА отношение риска развития ИМ в течение 1 года достигало 2,0 (при 95% ДИ от 0,8 до 5,1), при поражении 2 КА — 4,6 (при 95% ДИ от 2,0 до 10,5) и при поражении к 3 КА — 4,5 (при 95% ДИ от 1,6 до 12,5). При обструктивной КБС соответствующее отношение риска при поражении 1 КА достигало 9,0 (при 95% ДИ от 4,2 до 19,0), при поражении 2 КА — 16,5 (при 95% ДИ от 8,1 до 33,7) и при поражении 3 КА или обструктивной поражении ствола левой КА — 19,5 (при 95% ДИ от 9,9 до 38,2). Смертность в течение 1 года повышалась по мере увеличения распространенности КБС и была в диапазоне от 1,38% у больных без явной КБС до 4,3% у больных с поражением 3 КА или обструктивным поражением ствола левой КА. Результаты анализа, выполненного с учетом дополнительных факторов, свидетельствовали об отсутствии статистически значимой связи между необструктивным поражением 1 и 2 КА и смертностью, а также о наличии статистически значимой связи между необструктивной КБС с поражением 3 КА и смертностью (отношение риска 1,6 при 95% ДИ от 1,6 при 95% ДИ от 1,1 до 2,5). Кроме того, результаты такого анализа указывали на наличие статистически значимой связи между обструктивной КБС с поражением 1 КА и смертностью (отношение риска 1,9 при 95% ДИ от 1,4 до 2,6); такая же связь отмечена у больных с обструктивным поражением 2 КА (отношение риска 2,8 при 95% ДИ от 2,1 до 3,7) и у больных с обструктивным поражением 3 КА (отношение риска 3,4 при 95% ДИ от 2,6 до 4,4). Сходная связь отмечалась и для комбинированных показателей.
Наличие необструктивной КБС по сравнению с отсутствием явных признаков КБС сопровождается статистически значимым увеличением риска развития МИ и смерти в течение 1 года. Такие данные позволяют предположить клиническую значимость необструктивной КБС, что обусловливает необходимость клинических исследований для оценки эффективности вмешательств, направленных на улучшение прогноза у таких больных.
Инфаркт миокарда
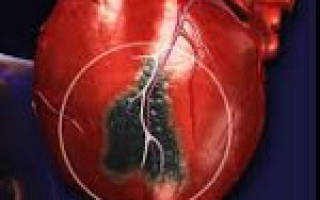
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
Общие сведения
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
В возрасте 40-60 лет инфаркт миокарда в 3–5 раз чаще наблюдается у мужчин в связи с более ранним (на 10 лет раньше, чем у женщин) развитием атеросклероза. После 55-60 лет заболеваемость среди лиц обоего пола приблизительно одинакова. Показатель летальности при инфаркте миокарда составляет 30—35%. Статистически 15—20% внезапных смертей обусловлены инфарктом миокарда.
Нарушение кровоснабжения миокарда на 15-20 и более минут приводит к развитию необратимых изменений в сердечной мышце и расстройству сердечной деятельности. Острая ишемия вызывает гибель части функциональных мышечных клеток (некроз) и последующее их замещение волокнами соединительной ткани, т. е. формирование постинфарктного рубца.
В клиническом течении инфаркта миокарда выделяют пять периодов:
- 1 период – предынфарктный (продромальный): учащение и усиление приступов стенокардии, может продолжаться несколько часов, суток, недель;
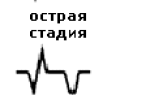
- 2 период – острейший: от развития ишемии до появления некроза миокарда, продолжается от 20 минут до 2 часов;
- 3 период – острый: от образования некроза до миомаляции (ферментативного расплавления некротизированной мышечной ткани), длительность от 2 до 14 суток;
- 4 период – подострый: начальные процессы организации рубца, развитие грануляционной ткани на месте некротической, продолжительность 4-8 недель;
- 5 период – постинфарктный: созревание рубца, адаптация миокарда к новым условиям функционирования.
Причины инфаркта миокарда
Инфаркт миокарда является острой формой ИБС. В 97—98% случаев основой для развития инфаркта миокарда служит атеросклеротическое поражение венечных артерий, вызывающее сужение их просвета. Нередко к атеросклерозу артерий присоединяется острый тромбоз пораженного участка сосуда, вызывающий полное или частичное прекращение кровоснабжения соответствующей области сердечной мышцы. Тромбообразованию способствует повышенная вязкость крови, наблюдаемая у пациентов с ИБС. В ряде случаев инфаркт миокарда возникает на фоне спазма ветвей венечных артерий.
Развитию инфаркта миокарда способствуют сахарный диабет, гипертоничесая болезнь, ожирение, нервно-психическое напряжение, увлечение алкоголем, курение. Резкое физическое или эмоциональное напряжение на фоне ИБС и стенокардии может спровоцировать развитие инфаркта миокарда. Чаще развивается инфаркт миокарда левого желудочка.
Классификация инфаркта миокарда
В соответствии с размерами очагового поражения сердечной мышцы выделяют инфаркт миокарда:
На долю мелкоочаговых инфарктов миокарда приходится около 20% клинических случаев, однако нередко мелкие очаги некроза в сердечной мышце могут трансформироваться в крупноочаговый инфаркт миокарда (у 30% пациентов). В отличие от крупноочаговых, при мелкоочаговых инфарктах не возникают аневризма и разрыв сердца, течение последних реже осложняется сердечной недостаточностью, фибрилляцией желудочков, тромбоэмболией.
В зависимости от глубины некротического поражения сердечной мышцы выделяют инфаркт миокарда:
- трансмуральный – с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый)
- интрамуральный – с некрозом в толще миокарда
- субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду
- субэпикардиальный – с некрозом миокарда в зоне прилегания к эпикарду
По изменениям, фиксируемым на ЭКГ, различают:
- «Q-инфаркт» – с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще крупноочаговый трансмуральный инфаркт миокарда)
- «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще мелкоочаговый инфаркт миокарда)
По топографии и в зависимости от поражения определенных ветвей коронарных артерий инфаркт миокарда делится на:
- правожелудочковый
- левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки
По кратности возникновения различают инфаркт миокарда:
- первичный
- рецидивирующий (развивается в срок 8 недель после первичного)
- повторный (развивается спустя 8 недель после предыдущего)
По развитию осложнений инфаркт миокарда подразделяется на:
По наличию и локализации болевого синдрома выделяют формы инфаркта миокарда:
- типичную – с локализацией боли за грудиной или в прекардиальной области
- атипичные – с атипичными болевыми проявлениями:
- периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная)
- безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная
- малосимптомную (стертую)
- комбинированную
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
- стадию ишемии (острейший период)
- стадию некроза (острый период)
- стадию организации (подострый период)
- стадию рубцевания (постинфарктный период)
Симптомы инфаркта миокарда
Предынфарктный (продромальный) период
Около 43% пациентов отмечают внезапное развитие инфаркта миокарда, у большей же части больных наблюдается различный по продолжительности период нестабильной прогрессирующей стенокардии.
Острейший период
Типичные случаи инфаркта миокарда характеризуются чрезвычайно интенсивным болевым синдромом с локализацией болей в грудной клетке и иррадиацией в левое плечо, шею, зубы, ухо, ключицу, нижнюю челюсть, межлопаточную зону. Характер болей может быть сжимающим, распирающим, жгучим, давящим, острым («кинжальным»). Чем больше зона поражения миокарда, тем более выражена боль.
Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов, а иногда и суток, не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью, возбуждением, чувством страха, одышкой.
Возможно атипичное течение острейшего периода инфаркта миокарда.
У пациентов отмечается резкая бледность кожных покровов, липкий холодный пот, акроцианоз, беспокойство. Артериальное давление в период приступа повышено, затем умеренно или резко снижается по сравнению с исходным (систолическое
Некоторые особенности патогенеза острого инфаркта миокарда при необструктивном поражении коронарных артерий
Инфаркт миокарда (ИМ) при необструктивном атеросклерозе или при интактных коронарных артериях выделен в отдельную группу – MINOCA (Myocardial infarction with no obstructive coronary atherosclerosis). В исследование включено 1240 пациентов. Первую группу составили пациенты с однососудистым поражением и полной острой окклюзией инфаркт-связанной коронарной артерии – 21,9 %. Вторую группу составили пациенты с острым инфарктом миокарда и необструктивным поражением коронарных артерий (стеноз менее 50 %) – НОАПКА – 7.7 %. Средний возраст пациентов группы 1 составил 56,59±11,6 лет, во второй группе – 67,9±11,5 лет (p<0.001). Сахарный диабет, ХБП, стенокардия напряжения, симптомы ХСН, артериальная гипертензия были более характерны для пациентов группы 2 по сравнению с группой 1: 20,8 и 7,4 % (р<0,05), 25,0 и 11,8 % (p<0,05), 29,2 и 14,7 % (p<0,05), 41,7 и 17,6 % (p<0,05), 91,7 и 72,1 % (p<0,01) соответственно. Рассмотрены некоторые механизмы развития некроза миокарда у пациентов с НОАПКА: нарушение целостности атеросклеротической бляшки без обструкции коронарной артерии и/или спонтанный тромболизис,
спонтанная диссекция интимы, инфекция, миокардиальный мостик, вазоспазм. Патогенез ИМ при необструктивном поражении коронарных артерий неоднозначен, и у одного пациента могут сочетаться несколько вариантов, что затрудняет диагностику и подбор адекватной терапии.
Список литературы:
1. Agewall S., Beltrame J. F., Reynolds H. R. [et al.] ESC working group position paper on myocardial infarction with non-obstructive coronary arteries. Eur. Heart. J. 2017;38(3):143-153. doi: 10.1093/eurheartj/ehw149
2. Bugiardini R., Bairey Merz C. N. Angina with «normal» coronary arteries: a changing philosophy. JAMA 2005;293:477–484. doi: 10.1001/jama.293.4.477
3. Bugiardini R., Manfrini O., De Ferrari G. M. Unanswered questions for management of acute coronary syndrome: risk stratification of patients with minimal disease or normal findings on coronary angiography. Arch. Intern. Med. 2006;166:1391–1395. doi: 10.1001/archinte.166.13.1391
4. Escolar E., Weigold G., Fuisz A [et al.] New imaging techniques for diagnosing coronary artery disease. CMAJ. 2006;174:487–495. doi: 10.1503/cmaj.050925
5. Gehrie E. R., Reynolds H. R., Chen A. Y. [et al.] Characterization and outcomes of women and men with non-ST-segment elevation myocardial infarction and nonobstructive coronary artery disease: results from the Can Rapid Risk Stratification of Unstable Angina Patients Suppress Adverse Outcomes with Early Implementation of the ACC/AHA Guidelines (CRUSADE) quality improvement initiative. Am. Heart. J. 2009;158:688–694. doi: 10.1016/j.ahj.2009.08.004
6. Hwang In-Chang. Statin therapy is associated with lower all-cause mortality in patients with nonobstructive coronary artery disease. Atherosclerosis 2015;239(2):335–342. doi: 10.1016/j.atheroscle-rosis. 2015.01.036
7. Jia H., Abtahian F., Aguirre A. D. [et al.] In vivo diagnosis of plaque erosion and calcified nodule in patients with acute coronary syndrome by intravascular optical coherence tomography. J. Am. Coll. Cardiol. 2013 Nov 5;62(19):1748-1758. doi: 10.1016/j.jacc.2013.05.071
8. Kardasz I., R. De Caterina. Myocardial infarction with normal coronary arteries: a conundrum with multiple aetiologies and variable prognosis: an update. JIM. 2007;261(4):330-348. doi: 10.1111/j.1365-2796.2007.01788.x
9. Masanobu I., Koichi K., Koji S. [et al.] Impact of aspirin on the prognosis in patients with coronary spasmwithout significant atherosclerotic stenosis. IJC. 2016;220:328-332. doi: 10.1016/j.ijcard.2016.06.157
10. Ohba K., Seigo S., Hitoshi S. [et al.] Microvascular Coronary Artery Spasm Presents Distinctive Clinical Features With Endothelial Dysfunction as Nonobstructive Coronary Artery Disease. J. Am. Heart. Assoc. 2012;1:e002485. doi: 10.1161/JAHA.112.002485
11. Okazaki S., Yokoyama T., Miyauchi K. [et al.] Early statin treatment in patients with acute coronary syndrome: demonstration of the beneficial effect on atherosclerotic lesions by serial volumetric intravascular ultrasound analysis during half a year after coronary event: the ESTABLISH Study. Circulation. 2004;110(9):1061-1068. doi: 10.1161/01.CIR.0000140261.58966.A4
12. Ouldzein H., Elbaz M., Roncalli J. [et al.] Plaque rupture and morphological characteristics of the culprit lesion in acute coronary syndromes without significant angiographic lesion: analysis by intravascular ultrasound. Ann. Cardiol. Angeiol. (Paris) 2012;61:20–26. doi: 10.1016/j.ancard.2011.07.011
13. Raggi P., Taylor A., Fayad Z. [et al.] Atherosclerotic plaque imaging: contemporary role in preventive cardiology. Arch. Intern. Med. 2005;165:2345–2353. doi: 10.1001/archinte.165.20.2345
14. Reynolds H. R., Srichai M. B., Iqbal S. N. [et al.] Mechanisms of myocardial infarction in women without angiographically obstructive coronary artery disease. Circulation. 2011;124:1414–1425. doi: 10.1161/CIRCULATIONAHA.111.026542
15. Roberts James R. Angiotensin-Converting Enzyme (ACE) Inhibitor Angioedema: The Silent Epidemic. AJC. 2012; 109 (5):774–775. doi: 10.1016/j.amjcard.2011.11.014
16. Taher T., Fu Y., Wagner G. [et al.] Aborted myocardial infarction in patients with ST-segment elevation: insights from the Assessment of the Safety and Efficacy of a New Thrombolytic Regiment-3 rial Electrocardiographis Substudy. J. Am. Coll. Cardiol. 2004;44:38–43. doi: 10.1016/j.jacc.2004.03.041
17. Terkelsen C. J., Norgaard B. L., Lassen J. F. [et al.] Potential significance of spontaneous and interventional ST-changes in patients transferred for primary percutaneous coronary intervention: observations from the ST-MONitoring in Acute Myocardial Infarction study (The MONAMI study). European Heart J. 2006;27:267–275. doi: 10.1093/eurheartj/ehi606
18. Thygesen K., Joseph S. Alpert, Allan S. Jaffe [et al.] Third Universal Definition of Myocardial Infarction. Circulation. 2012;126:2020-2035. doi: 10.1161/CIR.0b013e31826e1058
19. Ueda Y., Hinoi T., Matsuo S. [et al.] Intravascular ultrasoundguided coronary artery stenting for spontaneous coronary artery dissection in a case of acute myocardial infarction associated with vasospasm in a non-culprit coronary artery during the hospitalization. Intern. Med. 2006;45:763–767. doi: 10.2169/internalmedicine. 45.1688
Ключевые слова: инфаркт миокарда, необструктивный атеросклероз коронарных артерий, интактные коронарные артерии